PROPIEDADES COLIGATIVAS DE LAS SOLUCIONES
PROPIEDADES COLIGATIVAS DE LAS SOLUCIONES
Cuando dos o más sustancias se mezclan para dar origen a una solución, el resultado es una sustancia con una serie de propiedades físicas propias, diferentes a las de las sustancias originales. Estas propiedades reciben el nombre de propiedades coligativas y dependen directamente de la concentración del soluto y no de su naturaleza química. Estas propiedades son:
Presión de vapor
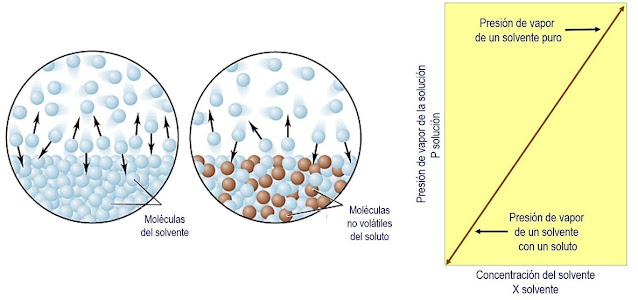
La presión de vapor es la presión que ejerce la fase gaseosa o vapor sobre la fase líquida en un sistema cerrado a una temperatura determinada de un disolvente; esta desciende cuando se le añade un soluto no volátil. Este efecto es el resultado de dos factores:
la disminución del número de moléculas del disolvente en la superficie libre
la aparición de fuerzas atractivas entre las moléculas del soluto y las moléculas del disolvente, dificultando su paso a vapor. Cuanto más soluto añadimos, menor es la presión de vapor observada.
La proporción entre las fases líquida - gaseosa depende de la fuerza de cohesión existente entre las moléculas. Si la cohesión es débil una gran cantidad de moléculas se volatilizarán, mientras que si la cohesión es fuerte, pocas serán las que lo consigan. Esto es lo que determina que unas moléculas se evaporen o volatilicen más rápidamente que otras.
La presencia de un soluto disminuye la presión de vapor de un solvente.
A medida que aumenta la temperatura, también aumenta la presión de vapor
Punto de ebullición o elevación ebulloscópica
La temperatura de ebullición de un líquido es aquélla a la cual su presión de vapor iguala a la atmosférica. La elevación de la temperatura de ebullición es proporcional a la concentración del soluto. Es decir que a mayor cantidad de soluto en una solución, mayor será la temperatura de ebullición.
La presencia de sal en la solución aumenta la temperatura de ebullición del agua
Punto de congelación o descenso crioscópico
En las soluciones que contienen un soluto no volátil se observa un descenso de la temperatura de congelación, con relación a la temperatura de congelación del solvente puro. La congelación se produce cuando la presión de vapor del líquido iguala a la presión de vapor del sólido.
Esto explica porque el agua del mar no se congela a grandes profundidades a pesar de estar a varios grados centígrados bajo cero. La razón por la cual el agua permanece en estado líquido es la concentración de sales disueltas (unos 35 gr de sales, principalmente cloruro sódico, por kg de agua) que disminuyen la temperatura de congelación del agua marina.
Este principio también se emplea con los anticongelantes que se aplican a los motores en climas muy fríos para evitar que el agua se congele en los radiadores.
Presión osmótica
Se define la presión osmótica como la tendencia a diluirse de una disolución separada del disolvente puro por una membrana semipermeable (es decir que permite el paso del solvente pero no del soluto) o también puede definirse como la presión que se debe aplicar a una solución para detener el flujo neto de disolvente a través de una membrana semipermeable. Un soluto ejerce presión osmótica al enfrentarse con el disolvente sólo cuando no es capaz de atravesar la membrana que los separa. La presión osmótica de una disolución equivale a la presión mecánica necesaria para evitar la entrada de agua cuando está separada del disolvente por una membrana semipermeable. La presión osmótica es directamente proporcional a la cantidad o concentración del soluto.




Comentarios
Publicar un comentario