LA TABLA PERIÓDICA
LA TABLA PERIÓDICA (grado septimo)
El desarrollo de la tabla periódica tuvo una larga historia. El primer intento de organizar los elementos químicos lo realizó Johann Dobereiner en 1829, quien logró organizar los elementos conocidos en un sistema de grupos de tres o triadas. Posteriormente John Newlands organizó este en grupos de ocho u octavas. Pero fueron Dimitri Mendeléyev y Lothar Meyer quienes en 1869 dieron forma a la tabla periódica actual.
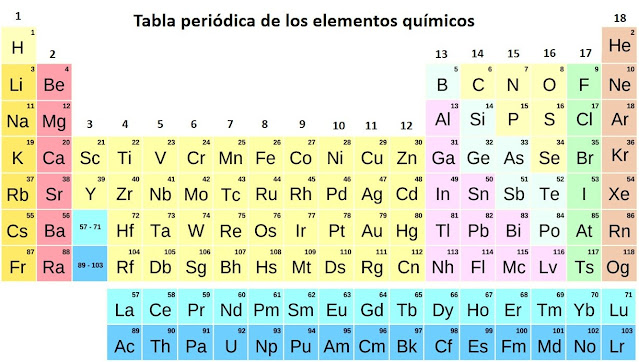
La tabla periódica clasifica, organiza y distribuye los distintos elementos químicos, conforme a sus propiedades y características, las cuales se repiten de alguna manera a lo largo de las filas y columnas derivando de ahí su nombre.
Las propiedades periódicas
Se llaman así porque muestran variaciones periódicas que dependen de la estructura de los átomos, su nivel de valencia y su distancia con respecto al núcleo. Las propiedades periódicas son:
El radio atómico: que es una medida del tamaño que tiene el átomo.
La electronegatividad: que representa la fuerza relativa de un átomo para atraer electrones cuando se combina químicamente con otro átomo.
La energía de ionización: que es la energía mínima requerida para quitarle a un átomo neutro en estado gaseoso uno de los electrones más débilmente atraídos por el núcleo. Al quitarle un electrón a un átomo neutro este queda con carga positiva y se conoce como ion positivo o catión.
La afinidad electrónica: es la energía liberada cuando un átomo neutro en estado gaseoso gana un electrón y queda con una carga negativa; es decir, forma un ion negativo o anión.
La organización de la tabla periódica
La distribución de las propiedades periódicas permite clasificar a los elementos químicos en grupos de la siguiente manera:
Grupo 1 metales alcalinos: Estos elementos químicos tienen un solo electrón en su último nivel de valencia; al reaccionar con el agua producen soluciones alcalinas o básicas.Grupo 2 metales alcalinotérreos: Los elementos de este grupo tienen dos electrones en su último nivel de valencia; cuando reaccionan químicamente pueden ceder o compartir estos electrones con otros elementos.
Grupos 3 al 12 metales de transición: Estos elementos se emplean en la elaboración de una gran cantidad de artículos de uso diario.
Grupo 13 familia del Boro: Forman parte de este grupo algunos elementos de carácter no metálico, metálico y semimetálico. Algunos de estos elementos se usan como materiales de construcción por ser livianos y no oxidarse con facilidad.
Grupo 14 familia del carbono: También posee algunos elementos de carácter no metálico, metálico y semimetálico. Se llama así por la presencia del carbono, fundamental para los seres vivos.
Grupo 15 familia del nitrógeno: En este grupo se encuentran el nitrógeno y el fósforo fundamentales para las plantas y para el desarrollo de los demás seres vivos.
Grupo 16 familia del oxígeno: Forman parte de este grupo el oxígeno y el azufre que son fundamentales en la química de los seres vivos.
Grupo 17 halógenos: Son elementos no metálicos que tienden a capturar electrones, se llaman así porque están involucrados en la formación de algunas sales.
Grupo 18 gases nobles: Estos elementos tienen muy poca tendencia a formar compuestos con otros elementos químicos y tienden a estar en estado gaseoso.
Tierras raras: Estos elementos tienen una baja abundancia en la naturaleza. Están formados por los lantánidos y los actínidos y muchos son radiactivos.
Bloques de la Tabla Periódica
La Tabla Periódica se divide en cuatro bloques según el orbital que están ocupando los electrones más externos (bloque s, p, d y f).
Bloque s: elementos cuyo orbital de valencia es un orbital s (permite 2 electrones → 2 elementos por nivel).
Bloque p: elementos cuyo orbital de valencia es un orbital p (permite 6 electrones → 6 elementos por nivel).
Bloque d: elementos cuyo orbital de valencia es un orbital d (permite 10 electrones → 10 elementos por nivel).
Bloque f: elementos cuyo orbital de valencia es un orbital f (permite 14 electrones → 14 elementos por nivel).





Comentarios
Publicar un comentario